![]() 元素周期表的应用
元素周期表的应用
【学习目标】
1.掌握同周期、同主族元素性质的递变规律。
2.了解元素周期律及元素周期表的应用。
3.掌握“位、构、性”之间的关系。
【学习重难点】
重点:同周期、同主族元素性质递变规律。
难点:元素“位、构、性”三者间的关系。
【学习过程】
【复习回顾】
1.元素周期表共分为____个周期;____个主族。第三周期共有____种元素,按原子序数递增顺序分别为________________。它们最高价氧化物的化学式分别为____________________;最高价氧化物水化物的化学式分别为______________________________。
2.写出以下反应的化学方程式:
①Na与水的反应:____________________________________;
②Mg与盐酸的反应:____________________________________;
③Al与盐酸的反应:____________________________________;
④氢气与氯气的反应:____________________________________。
3.第三周期元素原子核外电子排布规律为____________________________________。
根据这种电子排布规律预测第三周期元素原子得失电子能力相对强弱为_______________;其中____________主要体现为得电子;____________主要体现为失去电子,____________性质稳定。
一、认识同周期元素的递变规律:
1.探究Na、Mg、Al元素失电子能力的递变实验
[比较元素失电子能力强弱的间接方法]
①三种金属与水反应的反应差异__________________________________。
②镁铝与同浓度的稀盐酸的反应的差异_________________________________。
③金属单质与盐溶液的反应_________________________________。
④对应碱的碱性强弱_________________________________。
得出结论:__________________________________________________________________
2.比较硅、磷、硫、氯得电子能力的强弱
[探究]对硅、磷、硫、氯得电子能力的强弱的预测(请分别用化学式表示)
①单质与氢气化合的难易程度_________________________________;
②生成气态氢化物的稳定性强弱顺序为_________________________________;
③最高价氧化物水化物酸性的强弱顺序为_________________________________;
得出结论:硅、磷、硫、氯得电子能力的强弱顺序为:________________________;
二、同周期元素递变规律
1.同周期元素原子_____________相同,但从左至右核电荷数__________,原子半径______,原子失电子能力__________,得电子能力__________。这种情况周而复始,体现了元素性质随原子序数递增呈现__________变化。例如:第四周期也是自左至右,由_______过渡到______________,再过渡到__________,最后是__________。
2.同周期元素自左至右:最高正价_______________,最低负价__________,最高价氧化物水化物____________________,金属元素单质与水或酸反应__________,非金属元素与氢气反应__________,生成的气态氢化物__________。
三、预测同主族元素的性质:
1.归纳同主族元素性质的相似性和递变性
(1)卤素性质的相似性和递变性
①相似性:
a.结构:原子的最外层都是______个电子,其他层为______结构。
b.性质:卤素均为活泼的______元素;最高正价为____________(F除外),最低负价为______;最高价氧化物对应水化物都显_____性;都可形成形式为______的气态氢化物。
②递变性:
a.结构:从F到I,核外电子层数______,原子半径______。
b.性质:从F到I,得电子能力______,从而单质的氧化性______。
[预测与验证]
根据性质的递变性,试预测卤素与氢气化合的难易程度、生成气态氢化物的稳定性,以及它们对应最高价氧化物水化物的酸性,并阅读教材验证你的推测是否正确。
[观察与思考]预测金属钾的性质
1.试根据卤素性质的相似性和递变性,并根据金属钾在周期表中的位置预测其性质,并与其相邻的钠进行对比:
2.根据问题1中的预测,K与水反应应当比Na______,观察实验并验证你的预测是否正确(实验中应注意安全,务必将金属表面煤油擦干净,结合实验现象及煤油的性质,思考这是为什么?)并描述K与水反应的实验现象。
(2)碱金属性质的相似性和递变性
①金属钾的性质
根据前面实验归纳金属K的性质和性质:
a.物理性质:____________________________________
b.化学性质:____________________________________
②根据金属K、Na结构和性质的对比,归纳碱金属元素结构上的相似性和递变性,并预测碱金属元素性质上的相似性和递变性。阅读教材验证你的预测。
a.碱金属元素的相似性:
结构上:____________________________________________________________
性质上:____________________________________________________________
b.碱金属元素的递变性:
结构上:________________________________________________________________
性质上:________________________________________________________________
四、同主族元素性质归纳
1.同主族元素最外层电子数______。自上而下,电子层数____________,原子半径______,得电子能力____________,失电子能力____________。
2.同主族元素自上而下:最高正价___________,最高价氧化物水化物__________________,金属元素单质与水或酸反应____________,非金属元素与氢气反应______,生成的气态氢化物______。
[知识运用]试根据S硫元素的性质预测硒元素及其对应化合物的性质。
[内容整合]
完成下表:总结元素周期表中同周期、同主族元素性质的递变规律。描述箭头指向的含义以及图中虚线的含义
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 0 | |
1 |
| 稀有气体元素 | |||||||
2 | B | ||||||||
3 | Al | Si | |||||||
4 | Ge | As | |||||||
5 | Sb | Te | |||||||
6 |
| Po | At | ||||||
7 | |||||||||
(1)从原子结构角度分析,元素的性质为什么呈现上述递变规律?
(2)怎样根据元素在周期表中的位置,预测它的性质?
(3)总结元素在周期表中其“位置”、“结构”、“性质”三者之间的关系。
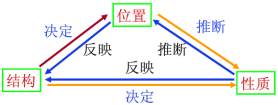

【规律总结】
位性关系:
元素及其化合物的性质(包括元素的金属性和非金属性,元素的化合价、元素原子半径大小)和元素在周期表中的位置的关系的规律
1.元素的化合价:
(1)主族序数=最外层电子数(即价电子数)=最高正价数(O、F除外);
(2)|最高正价|+|负价|=______;
(3)正负化合价代数和等于(即绝对值之差)

(4)“价奇序奇,价偶序偶”规律:奇数族元素一般具有奇数价,偶数族元素一般具有偶数价(N、Cl的偶数价氧化物除外)。
2.元素金属性非金属性强弱实验判断依据
金属性强弱实验依据
(1)常温下与水或酸反应的难易程度。与水或酸反应越容易,金属性越______。
(2)最高价氧化物对应水化物的碱性强弱。碱性越强,对应元素的金属性越______。
(3)金属在金属活动性顺序表中的位置。越往前,金属性越______。
(4)金属间的置换反应。金属性强的金属能置换出金属性弱的金属。
(5)金属阳离子的氧化性强弱(极少数除外)。阳离子的氧化性越强,对应金属的金属性越弱。
非金属性强弱实验依据
(1)与H2化合的难易和气态氢化物的稳定性。与氢气反应条件越容易,氢化物越______,则对应元素的非金属性越______。
(2)最高价氧化物对应水化物的酸性强弱(F除外)。酸性越强,对应元素的非金属性越______。
(3)非金属之间的置换反应。非金属性强的单质______置换出非金属性弱的单质。
(4)非金属的简单阴离子还原性的强弱。阴离子还原性越强,对应非金属单质的氧化性越______。
(5)与同一可变价金属反应,生成物中金属元素价态的高低。金属元素在该产物中价态越高,则说明该非金属元素的非金属性越______。
3.分界线规律:
位于金属与非金属之间的分界线,右上方的元素为非金属(周期表中的颜色为深绿色),在此可以找到制造农药的元素(如Cl、P等),左下方为金属元素(H除外),分界线两边的元素一般既有______性,又有______性;能与酸和碱反应(如Be、Al等),还可找到制造半导体材料的元素(如Si、Ge等)。
4.对角线规则:
位于元素周期表中对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。包括以下两点内容:
![]() 表中金属与非金属分界线方向( ),对角相邻的两主族元素(都是金属或非金属)性质(金属性或非金属性)相近。
表中金属与非金属分界线方向( ),对角相邻的两主族元素(都是金属或非金属)性质(金属性或非金属性)相近。
![]() ②元素周期表中左上右下( )相邻的两金属元素的离子半径相近。
②元素周期表中左上右下( )相邻的两金属元素的离子半径相近。
注意:特殊知识点总结

【基础巩固】
1.阅读教材,总结元素周期表在哲学、自然科学和实际应用的重要价值,并举例说明之。还原性随原子序数的增加而增强的是( )
A.Na、Mg、Al B.Na、K、Rb C.P、S、Cl D.I-、Br-、Cl-
2.下列递变规律不正确的是( )
A.Na、Mg、Al还原性依次减弱 B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次减小 D.P、S、Cl最高正价依次升高
3.(镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
A.在化合物中呈+2价 B.单质能与水反应放出氢气
C.镭比钙的金属性弱 D.碳酸镭难溶于水
4.同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
A.原子半径:X>Y>Z B.气态氢化物的稳定性:HX>H2Y>ZH3
C.非金属性:X>Y>Z D.阴离子的还原性:Z3->Y2->X-
5.A元素的阳离子和B元素的阴离子具有相同的电子层结构。下列叙述正确的是( )
A.原子半径:A<B B.原子序数:A>B
C.原子最外层上电子数:B>A D.A的正价与B的负价的绝对值相等
6.下列叙述中正确的是:( )
A.同主族金属的原子半径越大单质的还原性越强
B.稀有气体原子序数越大密度越小
C.同主族半径越大单质的氧化性越大
D.同周期元素的原子半径越小越易失去电子
7.已知元素X、Y的核电荷数分别是a和b,且它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式中正确的是:( )
A.a=b+m+n B.a=b-m+n C.a=b+m-n D.a=b-m-n
8.a、b、c三种元素的原子序数均小于20,a、b两元素的阳离子和c元素的阴离子都有相同的电子层结构,a原子的半径大于b原子的半径,则三种元素的原子序数的关系是( )
A.a>b>c B.b>a>c C.c>b>a D.a>c>b
9.下列叙述不正确的是( )
A.H2S、H2O、HF的稳定性依次增强
B.RbOH、KOH、Ca(OH)2的碱性依次减弱
C.Na+、Mg2+、Al3+的还原性依次减弱
D.H4SiO4、H2CO3、H2SO4的酸性依次增强
10.A、B为同周期元素,如果A原子半径比B原子半径大,则下列判断中正确的是( )
A.两元素形成的最高价氧化物对应水化物的酸性应:A强于B
B.A的气态氢化物比B的气态氢化物稳定
C.A的金属性比B的金属性强
D.A的阴离子比B的阴离子还原性弱。
【能力提升】
1.在元素周期表中相邻元素的性质相似,镓(Ga)在周期表中位于第4周期IIIA族,下列关于镓的说法错误的是( )
A.镓的最高价氧化物的水化物既能与强酸反应又能与强碱反应
B.氯化镓溶液能与烧碱溶液反应
C.镓的单质不能与盐酸反应
D.镓可形成[Ga(OH)4]-
2.X和Y元素的原子,在化学反应中都容易失去电子,形成与Ne相同的电子层结构,X原子的半径小于Y原子的半径,下列说法正确的是( )
A.X的金属性强于Y
B.常温下,X和Y都不能从水中置换氢
C.Y元素的氢氧化物碱性比X元素的氢氧化物碱性强
D.X元素的最高化合价比Y元素的最高化合价高
3.锂和镁在元素周期表中有特殊的“对角线关系”,它们的性质相似,下列有关锂及其化合物性质的叙述,正确的是( )
A.Li2SO4难溶于水 B.Li在氮气中燃烧生成Li3N
C.LiOH易溶于水 D.Li2CO3受热易分解
4.下列叙述正确的是( )
A.同周期元素的原子半径VIIA族的为最大
B.在周期表中0族元素的单质全部是气体
C.IA、IIA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时最高价都和它的族序数相等
【课后练习】
1.(2006江苏卷9)X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
2.下表是元素周期表的一部分,回答下列问题:
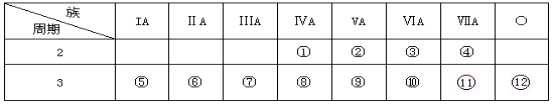
(1)写出①、②两种元素的名称______、______。
(2)写出⑧、⑨两种元素的符号______、______。
(3)在这些元素中,______是最活泼的金属元素;______是最活泼的非金属元素;______是最不活泼的元素。(用元素符号填写)
(4)这些元素的最高价氧化物对应水化物中最强的酸是________;最强的碱是________;两性氢氧化物是______。(填化学式)
(5)从⑤到![]() 的元素中,________原子半径最小。(用元素符号填写)
的元素中,________原子半径最小。(用元素符号填写)
(6)比较⑤与⑥的化学性质,________(用元素符号填写)更活泼,试用实验证明此现象(简述操作、现象和结论)_________________________________________________
3.镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是( )
A.镭比钙的金属性更强 B.在化合物中是+2价
C.镭是一种放射性元素 D.氢氧化镭呈两性
4.下列各组中的性质比较中,不正确的是( )
A.酸性HClO4>HBrO4>HIO4
B.碱性Ba(OH)2>Ca(OH)2>Mg(OH)2
C.还原性F->Cl->Br-
D.稳定性HCl>H2S>PH3
5.可用来判断金属性强弱的依据是( )
A.原子电子层数的多少 B.最外层电子数的多少
C.最高价氧化物的水化物的碱性强弱 D.等物质的量的金属置换氢气的多少
6.0.75摩尔RO32-共有30摩尔电子,则R在周期表中位置是( )
A.第二周期 B.第三周期 C.第IVA族 D.第VIA族
7.若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是( )
A.1 B.3 C.5 D.6
8.在元素周期表中,金属元素与非金属元素分界线附近能找到( )
A.制半导体材料的元素 B.制农药的元素
C.制催化剂的元素 D.制耐高温合金的元素
9.同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
A.原子半径X>Y>Z B.气态氢化物的稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z D.阴离子的还原性Z3->Y2->X-
10.短周期中三元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是:( )
A.a是一种活泼的非金属元素
B.c的最高价氧化物的水化物是一种弱酸
C.b的氢化物很稳定
D.b元素的最高化合物为+7价
 11.元素周期表的一部分,按要求完成各小题。
11.元素周期表的一部分,按要求完成各小题。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ⑾ | |||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)化学性质最不活泼的元素________,(填元素编号,下同),非金属性最强的元素是________。金属性最强的单质与水反应的离子方程式为_________________________。
(2)①③⑤三种元素的最高价氧化物水化物中,碱性最强的________。
(3)①③⑤三种元素的原子半径由大到小的顺序为________________。
(4)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为________。在两种盐中该元素的化合价为________,该元素的最高价氧化物和盐酸反应的化学方程式为________,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为________________________________________。