研究物质性质的方法和程序
【学习目标】
1.根据金属单质的结构和性质,预测金属钠的性质并进行探究。
2.观察金属钠及金属钠与水反应的现象。
3.探究金属钠和氧气反应的实验。
4.初步学会研究物质性质的基本方法——观察法、实验法、分类法和比较法。
5.能初步运用观察、实验、分类、比较等科学方法研究氯气的性质。
6.能说出氯气的主要物理性质(颜色、气味、状态、溶解性等),认识氯气与非金属、金属、水、碱的化学反应并会书写其化学方程式。
7.能利用氯气的化学性质分析一些简单的实验现象和实际问题。
【学习重难点】
1.知道钠的保存,了解钠的用途。
2.钠的与非金属单质,水、盐溶液化学性质。
3.过氧化钠与二氧化碳和水的反应。
4.氯气的物理性质和化学性质。
5.初步学会以观察、实验、比较、分类等方法在研究物质性质中的运用,初步掌握研究物质的一般程序。
【学习过程】
第一课时
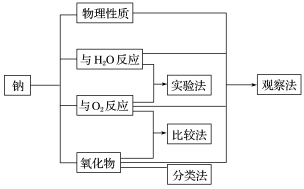
一、研究物质性质的基本方法: 、 、 、 。
二、金属钠性质的探究
1.钠的物理性质
实验步骤 | 实验现象 | 解释及结论 |
| ||
|
2.钠与水的反应
实验步骤 | 实验现象 | 现象分析 |
| ||
结论 | ||
思考:
(1)Na着火可以用水灭火?泡沫灭火器呢?应该怎么办?
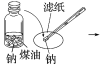
(2)钠能否保存在四氯化碳或汽油中?
(3)设计出收集并检验该反应中放出的气体的装置?
(4)将金属钠(密度为0.9788g/cm3)放入煤油(密度为0.8g/cm3)和水的混合物中,你推测可能会观察到什么现象?并解释原因。
(5)在金属活动顺序表中,钠排在铜的前面,所以,将钠加入到CuSO4溶液或氯化铁溶液中,会置换出金属铜或铁。这种说法对吗?
总结:
3.钠与氧气的反应
实验操作 | 实验现象 | 实验结论 |
| ||
|
注意:(1)固体加热,使用坩埚,泥三角、三脚架
(2)反应条件不同,产物不同
思考:(1)在实验室中如何保存金属钠?为什么?
(2)上述研究过程运用的方法有: 。
(3)刚切开的钠在空气中放置发生哪些变化?
(4)请比较金属钠与其他金属在性质上的相同点和不同点。
(5)在研究金属钠的性质的过程中,你用到了那些研究方法?
(6)金属元素化合物的学习线索。
4.氧化钠和过氧化钠的比较
名称 | 氧化钠 | 过氧化钠 |
化学式 | ||
氧的化合价 | ||
生成条件 | ||
颜色、状态 | ||
与H2O的反应 | ||
与CO2的反应 | ||
与盐酸的反应 | ||
稳定性 | ||
用途 |
总结:
第二课时
一、研究物质性质的基本程序
(1)研究物质性质的一般程序为观察_______________、预测_______________、通过_______________、最终得到_______________。
(2)在研究物质性质过程中用到哪些研究方法?
(3)我们通常从哪些方面研究物质?
二、研究物质性质的案例——研究氯气的性质
认识物质的物理性质
实验内容 | 实验现象 | 实验结论 |
[实验1] 取一只盛满氯气的集气瓶,观察氯气的颜色:用手轻轻地在瓶口煽动,使极少量的氯气飘近鼻孔,闻氯气的气味。 [实验2] 取一只盛满氯气的试管,将其倒扣在水槽中,用手轻轻摇动试管,观察现象。 |
交流与讨论:
1.你知道通常从哪些方面认识物质的物理性质吗?
2.氯气的物理性质有哪些特点?
总结:
1.氯气物理性质:
(一)预测氯气的化学性质
问题思考:
1.氯气是一种活泼的非金属单质,你认为它可能具有哪些化学性质?(与同类物质氧气的性质进行比较)
2.你将通过哪些实验验证你的推测?
(二)实验验证过程
实验内容 | 实验现象 | 实验结论 |
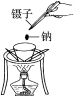
【实验1】取一块绿豆粒大小的金属钠,用滤纸吸干煤油,切去表层,放在石棉网上,用酒精灯微热。待金属钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠球的上方,观察现象。 | ||
【实验2】用坩埚钳夹住一束铁丝,灼烧后立刻放入充满氯气的集气瓶中,观察发生的现象。然后把少量的水注入氯气瓶里,用玻璃片盖住瓶口,振荡,观察溶液的颜色。 | ||
【实验3】用坩埚钳夹住一束铜丝,灼烧后立刻放入充满氯气的集气瓶中,观察发生的现象。然后把少量的水注入氯气瓶里,用玻璃片盖住瓶口,振荡,观察溶液的颜色。 | ||
【实验4】在空气中点燃氢气(点燃前要“验纯”),然后把导管伸入盛有氯气的集气瓶中,观察氢气在氯气中燃烧的现象。 |
(三)分析、解释及结论
2.氯气的化学性质
(1)与金属单质的反应:
Cl2 + 2Na 2Fe + 3Cl2 Cu + Cl2
(2)与非金属单质的反应:
Cl2+H2
(3)氯气与水的反应:
(4)氯气与碱的反应:
问题思考:
1.新制氯水的成分 。
2.久置氯水的成分 。
【检测反馈】
第一课时
1.将一小块金属钠放在石棉网上加热,下列组合正确的是( )
①燃烧,黄色火星四射 ②金属钠先熔化 ③燃烧,火焰为黄色 ④燃烧后生成白色固体 ⑤燃烧后生成淡黄色固体
A.②① B.②①③ C.②③⑤ D.②③④
2.将一小块金属钠投入到下列溶液时,既能产生气体,又能出现白色沉淀的是( )
A.稀硫酸 B.氢氧化钠溶液 C.硫酸铜溶液 D.氯化镁溶液
3.下列判断正确的是( )
A.可用水来确定某Na2O粉末中是否含有Na2O2
B.可用CO2来确定某Na2O粉末中是否含有Na2O2
C.Na2O比Na2O2稳定
D.将足量的Na2O2.Na2O分别加到酚酞溶液中,最终溶液均为红色
4.下列叙述中不正确的是( )
A.Na2O2是淡黄色固体,Na2O是白色固体,二者都能与水反应生成NaOH
B.Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2O
C.Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
D.2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2 g
5.查阅资料得知,金属钠不仅能跟O2和H2O反应,还能跟多种其他物质反应,其中包括与酒精在常温下的反应。要研究金属钠跟酒精反应的性质以及该反应与金属钠跟水反应的异同点,下列研究方法中不需要的是( )
A.实验法 B.观察法 C.分类法 D.比较法
6.下列实验操作正确的是( )
A.向盛水的烧杯中投入小拇指头大小的钠块,观察现象
B.实验后剩余的钠不能放回原试剂瓶
C.将一小块钠放在石棉网上加热,观察现象
D.用手掰开一块金属钠,观察钠的颜色
7.将一块金属钠投入到滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生
③反应后溶液变红 ④钠熔成闪亮的小球
⑤小球在水面上四处游动 ⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤ C.②④⑤⑥ D.③④⑥
8.对于Na2O和Na2O2的下列叙述中不正确的是( )
A.均可做潜水艇的供氧剂 B.均可与水反应
C.Na2O可转化为Na2O2 D.均是金属氧化物
9.将金属钠分别投入到下列溶液中,溶液质量增加的是( )
A.FeCl3溶液 B.K2SO4溶液 C.MgCl2溶液 D.饱和NaOH溶液
10.有人设计出一种在隔绝空气的条件下让钠与MgSO4溶液反应的方法以验证反应实质。实验时,往100 mL大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入MgSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:
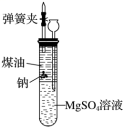
(1)如何从试剂瓶中取用金属钠?剩余的Na能否放回原试剂瓶? _______________。
(2)写出钠与MgSO4溶液反应的化学方程式:_________________________。
(3)钠处于试管中的_________位置,有关钠反应的现象是_____________________。
(4)大试管的溶液中出现的现象:__________________________________。
(5)装置中液面的变化:大试管内____________;长颈漏斗内____________。
第二课时
1.氯气能使紫色石蕊溶液( )
A.褪色 B.变成红色
C.先褪色后变红 D.先变红后褪色
2.饱和氯水久置后,溶液中的各种粒子:①Cl2;②H2O;③Cl-;④HClO;⑤ H+,减少的是( )。
A.①②④ B.①②③ C.①④ D.②④
3.检验氯化氢气体中是否混有氯气,可采用的方法是( )
A.用干燥的蓝色石蕊试纸 B.用干燥有色布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
4.已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl![]() (浓)===CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是( )
(浓)===CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是( )
①CO2 ![]() ②HCl ③H2O ④O2
②HCl ③H2O ④O2
A.①②③ B.②③④ C.②③ D.①④
5.“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已擦净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热到钠熔成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
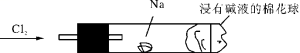
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉花球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.若在棉花球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
6.氯化碘的化学性质跟氯气相似,预计它跟水反应的最初生成物是( )
A.HI和HClO
B.HCl和HIO
C.HClO3和HIO
D.HClO和HClO3
7.下图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
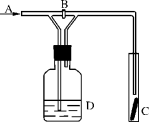
A.浓H2SO4 B.饱和NaCl溶液 C.浓NaOH溶液 D.氢氧化钙悬浊液
8.某同学研究氯水漂白性的一个探究性实验片断。
活动记录
[观察]氯气的颜色:黄绿色;氯水的颜色:呈黄绿色。
[结论]氯水中含有氯气分子。
[实验操作]用两根玻璃棒分别蘸取盐酸和氯水,各滴在两片蓝色石蕊试纸上。
[实验现象]滴有盐酸的试纸变红,滴有氯水的试纸中间变白,外圈变红。
[分析与结论]氯水呈黄绿色,说明氯水中溶有游离的氯气分子。滴有氯水的蓝色石蕊试纸外圈变红,说明氯水中有能使试纸变红的酸生成;中间变白,说明氯水中有能够使有色物质褪色的物质生成。
[问题与思考]氯气溶于水发生如下反应:Cl2+H2O===HCl+HClO,溶液中的水和盐酸都没有漂白作用,能够使有色物质褪色的物质是氯水中的氯气分子还是氯水中的次氯酸呢?还是二者都有漂白作用?
请你参照他已完成的部分实验活动记录,自己设计一个实验,证明到底是哪种物质有漂白作用。
[![]() 实验操作]_________________________________________________。
实验操作]_________________________________________________。
[实验现象]
______________________________________________________________________。
[分析与结论]
________________________________________________________________________
________________________________________________________________________。
9.用滴管将新制的饱和氯水慢慢滴入酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪去,试回答下列问题。![]()
(1)实验室保存饱和氯水的方法是________________________________。
(2)产生上述现象的![]() 原因可能有两种(用文字简要说明):
原因可能有两种(用文字简要说明):
①________________________________________________________________________;
②________________________________________________________________________。
(3)简述怎样用实验证明红色褪去的原因是①或②:
________________________________________________________________________
【答案】1.D 2.A 3.D 4.A 5.C 6.B 7.B
8.[实验操作]收集一集气瓶干燥的氯气,用镊子夹取一片一端湿润的有色纸条,深入到盛有干燥氯气的集气瓶中。
[实验现象]有色纸条湿润的一端颜色褪去,另一端无明显变化。
[分析与结论]干燥的有色纸条颜色不褪,证明氯气本身无漂白作用。又知水和盐酸都没有漂白作用,容易推知:湿润的有色纸条褪色,是因为氯气溶于水发生如下反应:Cl2+H2O===HCl+HClO,溶液中的HClO具有漂白作用。
9.(1)密封保存于棕色试剂瓶中,并置于阴凉处。
(2)①氯气与氢氧化钠反应生成两种盐,碱性减弱;②氯气过量后生成的次氯酸具有漂白性将溶液变成无色。
(3)向无色溶液中滴加氢氧化钠溶液,若不再出现红色,应为原因;②,若再出现红色,应为原因①。