| 酸和碱之间会发生什么反应(2) |
主讲: 化学高级教师 舒宝生
复习:中和反应:酸与碱作用生成盐和水的反应叫做中和反应。
注意:
1、中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。
如:(1)酸和某些金属氧化物反应生成盐和水。
2HCl+CuO=CuCl2+H2O
(2)碱和某些非金属氧化物反应生成盐和水。
Ca(OH)2+CO2=CaCO3↓+H2O
2、中和反应的实质是酸中的H+与碱中的OH-结合成水:H++OH-=H2O。
3、中和反应一般现象不明显(无沉淀、气体产生,无颜色改变),所以反应中借助酚酞试液的颜色变化判断反应是否恰好完成。
4、中和反应属于复分解反应。
一、中和反应的应用
1、改变土壤的酸碱盐。如用熟石灰中和土壤的酸性。
2、处理工厂的废水。如用熟石灰中和硫酸厂的污水(含有H2SO4等杂质)。
3、用于医药
如:用胃舒平(含氢氧化铝)等药物来医治胃酸过多的病人;
被蚊虫叮咬(蚊虫能在人的皮肤内分泌出蚁酸),如果涂一些含有碱性物质(如NH3·H2O)的药物水,可减轻痛痒。
当不小心被黄蜂刺了(黄蜂射出的汁液是碱性的),就可以用食醋涂在皮肤上以减轻痛痒。
(板书有误:此处视频中将“食醋”误写成了“食蜡”。)
二、溶液的酸碱度
1、定义:溶液酸碱性的强弱程度叫做溶液的酸碱度。
2、溶液酸碱性
酸性、中性、碱性(可用指示剂试验)。
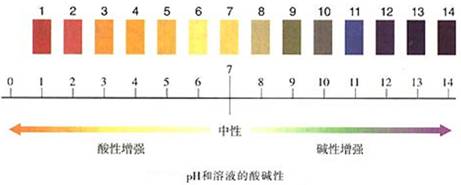
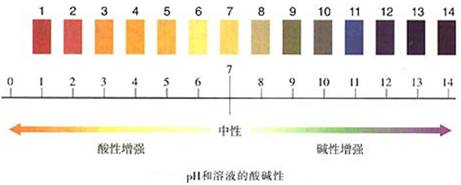
3、溶液酸碱度表示——用pH表示
(1)pH的范围通常在0~14之间。
(2)pH测定——最简便的方法是用pH试纸
测定方法:在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH。
注意:
①不能直接将pH试纸浸入待测溶液中。
②不能将pH试纸润湿后测溶液的pH,否则,待测液被稀释。
③pH试纸检验酸性或碱性气体时,可将pH试纸润湿。
4、溶液酸碱性和酸碱度的关系
酸性溶液的pH<7;碱性溶液的pH>7;中性溶液的pH=7。
注意:酸性溶液(碱性溶液)与酸溶液(碱溶液)是两组不同的概念。酸溶液一般呈酸性,但酸性溶液不一定是酸溶液;碱溶液一般呈碱性,但碱性溶液不一定是碱溶液。
三、常见物质的酸碱性
四、了解溶液酸碱度的重要意义
例1、某护发素的pH小于7,其水溶液显( )
A.碱性 B.酸性
C.中性 D.无法确定
答案:B
例2、结合下表中所列物质的pH判断,在下列各组物质中,分别能使紫色石蕊溶液变红、不变色、变蓝的是( )
物质
酱油
厕所
清洁剂
血浆
牙膏
肥皂水
橘汁
草木
灰水
柠檬汁
pH
4.8
1.7
7.4
8.2
9.2
3.5
10.6
2.5
A.柠檬汁、食盐水、厕所清洁剂
B.牙膏、蒸馏水、肥皂水
C.草木灰、蒸馏水、柠檬汁
D.橘汁、食盐水、草木灰水
答案:D
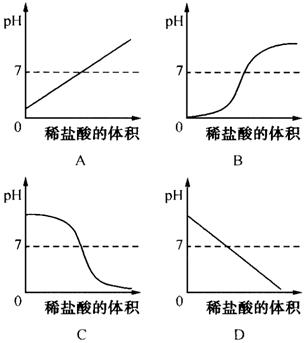
例3、向盛有10mL氢氧化钠溶液的烧杯中逐滴滴加稀盐酸,下图中能体现溶液pH变化情况的是( )
答案:C
总结:
一、中和反应的应用
二、溶液的酸碱度
- 返回 -