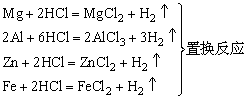| 常见的酸和碱 |
主讲: 化学高级教师 舒宝生
一、酸和碱的定义
1、酸:仅能电离出H+和酸根离子的化合物。
如:HCl、H2SO4、CH3COOH、HNO3
注意:(1)H2O、C2H5OH、CH4等虽然含有氢元素,但不是酸;
(2)NaHSO4等能电离出H+和SO42-,但不是酸;
(3)酸是化合物,酸溶液是混合物。
2、碱:仅能电离出金属阳离子(或NH4+)和OH-的化合物。
如:NaOH、Ca(OH)2、Ba(OH)2、KOH、Mg(OH)2、Cu(OH)2、NH3·H2O
注意:(1)Cu2(OH)2CO3等物质含OH-,但不是碱。
(2)碱是化合物,碱溶液是混合物。
过渡:酸溶液和碱溶液可用酸碱指示剂区分开来。
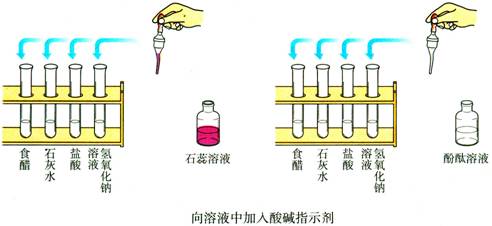
演示:将8支试管分成两组,每组的4支试管中分别加入少量食醋、石灰水、盐酸和氢氧化钠溶液。向其中一组试管中加入紫色石蕊溶液,向另一组试管中加入无色酚酞溶液。观察现象。
加入紫色石蕊溶液后的颜色变化
加入无色酚酞溶液后的颜色变化
食醋
石灰水
盐酸
氢氧化钠溶液
二、酸、碱指示剂(简称指示剂)
特点:跟酸或碱的溶液起作用而显示不同的颜色。
石蕊溶液:遇酸溶液显红色,遇碱溶液显蓝色,本身是紫色。
酚酞溶液:遇酸溶液不变色(无色),遇碱溶液显红色,本身是无色。
说明:指示剂一般可用植物的花瓣或果实捣烂,用酒精浸泡得到。关键:通过变色将酸溶液和碱溶液区分开。
例、取四种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁。各取少许花汁,用稀酸或稀碱进行检验,结果如下表所示:
花的种类
花汁在酒精中的颜色
花汁在酸溶液中的颜色
花汁在碱溶液中的颜色
大红花
粉红色
橙色
绿色
玫瑰
粉红色
粉红色
绿色
万寿菊
黄色
黄色
黄色
雏菊
无色
无色
黄色
则下列说法中不正确的是( )
A.研磨花瓣过程中加入酒精是为了溶解其中的色素
B.25℃时,遇到石灰水,玫瑰花汁会变成粉红色
C.万寿菊花汁不能用作酸碱指示剂
D.可用雏菊花汁来区别HCl和NaOH溶液
答案:B
三、常见的酸:盐酸(HCl)
1、盐酸的物理性质:无色有刺激性气味的液体,有挥发性,浓盐酸的挥发性较强,打开瓶塞会形成白雾。
思考:
(1)白雾是什么?
挥发出来的HCl和空气中的水蒸气结合形成的盐酸小液滴。(物理变化)
(2)盐酸敞开放置在空气中,溶质、溶质的质量分数怎样变化。
溶质和溶质的质量分数都变小。
2、盐酸的化学性质
(1)可使指示剂显色
(2)可与活泼金属反应产生H2
如:
演示:用盐酸除铁锈
(3)盐酸可与部分金属氧化物反应
Fe2O3+6HCl=2FeCl3+3H2O
现象:铁锈可被除掉,溶液由无色变为黄色。
CuO+2HCl=CuCl2+H2O
现象:盐酸可与氧化铜反应,溶液由无色变为蓝色。
Al2O3+6HCl=2AlCl3+3H2O
CaO+2HCl=CaCl2+H2O
3、用途
重要的化工产品,用于金属表面除锈、制造药物等;人体胃液中含有盐酸,可帮助消化。
思考:盐酸用于铁制品表面除锈时,能否长时间浸泡?
不能,盐酸可与铁锈反应,也可与铁反应。
Fe2O3+6HCl=2FeCl3+3H2O; Fe+2HCl=FeCl2+H2↑
例1、指出下列物质属于化合物中哪一类?
HCl、CO、CO2、CuO、H2SO4、NaOH、CaCO3、Ca(OH)2、H2O
例2、完成下列化学方程式,并说明体现了盐酸哪些性质。
1、Fe+HCl
2、Fe2O3+HCl
3、CaCO3+HCl
4、Na2CO3+HCl
5、Zn+HCl
6、CuO+HCl
总结:
一、酸和碱的定义
二、酸碱指示剂
石蕊溶液:
酚酞溶液:
三、常见的酸:盐酸(HCl)
- 返回 -