| 溶解度(3) |
主讲: 化学高级教师 舒宝生
复习:
1、溶解度的含义。
2、饱和溶液中,溶质、溶剂与溶解度的关系:
3、溶解度与溶解性的关系:
溶解度(20℃时)
大于10g
1~10g
0.01~1g
<0.01g
溶解性
易溶
可溶
微溶
难溶
4、影响溶解度的因素
5、溶解度的表示法
一、溶解度曲线
溶解度随温度变化的曲线
看图:
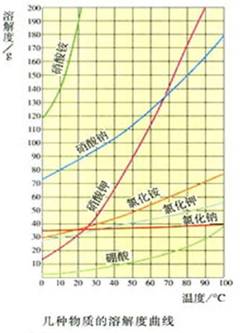
从溶解度曲线中你能得到什么信息?
1、溶解度曲线的作用
(1)表示某物质在不同温度下的溶解度;
(2)表示某物质的溶解度随温度变化的趋势及快慢;
(3)能很快的比较两物质在相同温度时溶解度的大小;
(4)两曲线相交时的含义:在该温度时,两物质的溶解度相等。
2、溶解度的变化规律
(1)大多数固体物质的溶解度随温度的升高而增大;
(2)少数固体物质的溶解度受温度的影响很小。如:NaCl
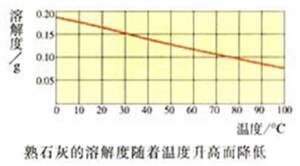
(3)极少数固体物质的溶解度随温度的升高而减小。如Ca(OH)2。
应用:
(1)饱和溶液与不饱和溶液之间的转化
Ca(OH)2等物质除外。
(2)如何用结晶法提纯物质。
例:已知:A、B的溶解度曲线如图所示
①若要从A溶液中得到A,一般采用降温结晶的方法;
②若要从B溶液中得到B,一般采用蒸发结晶的方法;
③若A中含有少量B,一般采用降温结晶的方法提纯A;
④若B中含有少量A,一般采用蒸发结晶的方法提纯B。
3、溶解度曲线平面上点的含义
(1)曲线上方的点
表示溶液为饱和溶液,且有晶体析出;
(2)曲线上的点:
表示该温度下的溶解度,溶液为饱和溶液;
(3)曲线下方的点
表示溶液为不饱和溶液。
应用:点的运动的考虑
二、气体溶解度
1、定义
某种气体在压强为101kPa,温度一定时,在1体积水中达到饱和状态时所溶解的体积。
2、影响因素
(1)气体本身的性质
(2)温度
温度升高,气体溶解度减小。
(3)压强
压强增大,气体溶解度增大。
例:如下图表示M、N两种固体物质的溶解度曲线。下列说法正确的是( )
A.20℃时,M的溶解度大于N的溶解度
B.M、N都不是易溶物质
C.P点表示t℃时M、N的溶解度相等
D.阴影处M、N均为饱和溶液
解析:
20℃时,M、N的溶解度都大于10g,所以M、N都是易溶物质。
答案:C
总结:
一、溶解度曲线
1、作用
2、溶解度的变化规律
3、溶解度曲线平面上点的含义
二、气体溶解度
1、定义
2、影响因素
- 返回 -


