| 溶解度(2) |
主讲: 化学高级教师 舒宝生
复习:物理性质一般包括的内容
颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、导电性、导热性、延展性等。
设问:什么是溶解性呢?
一、溶解性
1、定义:一种物质在另一种物质里溶解的能力称为溶解性。
2、溶解性的描述
难溶、微溶、可溶、易溶
3、特点:粗略的描述溶解能力。
复习:(1)I2在水中、汽油中的溶解情况?
(2)KMnO4在水中、汽油中的溶解情况?
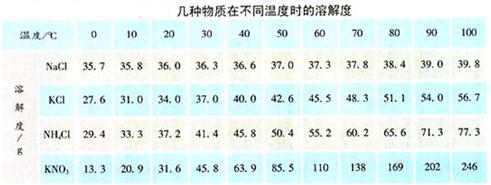
活动:探究KNO3在水中的溶解性受温度影响情况,并讨论出现该现象的原因。
4、影响溶解性的因素:
内因:溶质的种类、溶剂的种类;
外因:温度。
过渡:有没有一种精确的方法描述溶解能力的大小呢?这就是本节课重点要学习的溶解度。
引入:同学们知道,要比较两种物质的溶解能力的大小,应该在相同的条件下比较,请判断下列方法比较溶解能力大小是否合理。
(1)向盛有60℃水的烧杯中加入NaCl,向盛有20℃等量的水的烧杯中加入KNO3,都使其达到饱和,NaCl和KNO3谁能溶解的质量多,谁的溶解能力就大。
(2)在20℃时,向10g水中加入NaCl,向1000g水中加入KNO3,都使其达到饱和,NaCl和KNO3谁能溶解的质量多,谁的溶解能力就大。
(3)在20℃时,向100g水中加入NaCl至饱和状态,向100g水中加入KNO3配成不饱和溶液,NaCl和KNO3谁能溶解的质量多,谁的溶解能力就大。
总结:定量描述溶解能力的要素:
①温度;②等量的溶剂;③溶液达到饱和状态;④溶解的溶质的质量
说明:比较固体溶解能力的大小,只需满足在①、②、③相同的条件下,再比较④的大小。
过渡:为了定量的描述溶解能力的大小,引入了溶解度的概念,溶解度就是符合上述条件的。
二、溶解度
1、固体物质的溶解度定义:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
练习:
(1)20℃时,KNO3的溶解度是31.6g的含义:
20℃时,KNO3在100g水里达到饱和状态时所溶解的质量是31.6g。
或20℃时,KNO3在100g水里最多能溶解31.6g。
(2)判断正误:
①把20g某物质溶解在100g水中,恰好制成饱和溶液,该物质的溶解度就是20g。(×,未指明温度)
②20℃时,将20g NaCl溶解在一定量的水中制成饱和溶液,故20℃时,NaCl的溶解度是20g。(×,未指明溶液的量)
③20℃时,30g NaCl溶解在100g水里,故20℃时,NaCl的溶解度是30g。(×,未指明饱和状态)
④20℃时,36g NaCl溶解在100g水中恰好饱和,故20℃时,NaCl的溶解度是36。(×,未带单位“g”)
⑤60℃时,55g KNO3溶解在50g水中,恰好饱和,故60℃时,KNO3的溶解度是55g。(×,不是100g溶剂)
过渡:第⑤问中,60℃时,KNO3的溶解度是多少呢?
2、饱和溶液中,溶质、溶剂与溶解度的关系
t℃时,100g水中最多能溶解的溶质为S g
200g水中能溶解的溶质为2Sg
300g水中能溶解的溶质为2Sg
50g水中能溶解的溶质为
m(溶剂)水中能溶解的溶质为
即
例、60℃时,55g KNO3溶解在50g水中,恰好饱和,60℃时,KNO3的溶解度是多少?
解:
55/50 =S/100
S=110g
60℃时,KNO3的溶解度是110g。
3、溶解度与溶解性的关系
溶解度:精确表示溶解能力,
溶解性:粗略表示溶解能力。
溶解度(20℃时)
大于10g
1~10g
0.01~1g
<0.01g
溶解性
易溶
可溶
微溶
难溶
4、影响固体溶解度的因素
(1)溶质的种类;
(2)溶剂的种类;
(3)温度
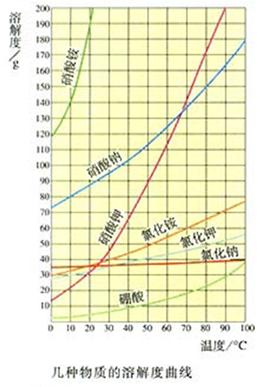
过渡:如何表示KNO3在不同温度下的溶解度呢?
5、溶解度的表示方法
(1)列表法
特点:①不能表示某物质在任意温度时的溶解度;②不能直观的表示某物质的溶解度随温度变化的趋势。
(2)图象法(描点法得到S随t变化的图象,即溶解度曲线。)
总结:

- 返回 -