| 溶液的形成(2) |
主讲: 化学高级教师 舒宝生
回顾:
一、溶液的概念
一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
二、溶质和溶剂的判断
固体、气体溶于液体时,液体为溶剂。
两种液体互溶时
三、影响溶解能力的因素
主要是:溶质的种类、溶剂的种类。
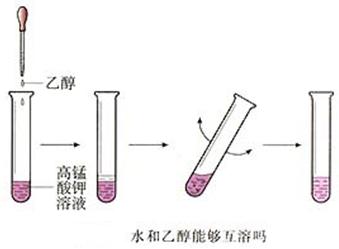
【实验】在盛有2mL水的试管中滴入2-3滴红墨水 (用红墨水是为了显色,利于观察) ,振荡,然后再用滴管缓缓加入约2 mL乙醇,不要振荡,观察溶液是否分层。然后振荡,有什么现象发生?
现象:水和乙醇互溶,不分层,形成溶液。
结论:溶质有乙醇,溶剂是水,可溶性物质溶解在适量水中,可以得到溶液。
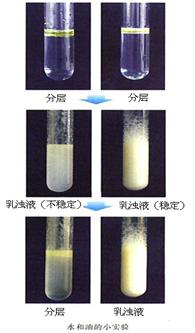
【实验】在2支试管中分别加入2~3mL水和几滴植物油,观察试管中的液体是否分层。向其中一支试管中滴入几滴洗涤剂。用胶塞分别塞紧试管,振荡,观察现象。静置几分钟,再观察现象。把2支试管内的液体倒掉,并用水冲洗试管,比较这两支试管的内壁是否干净。
一、乳浊液
1、定义:小液滴分散到液体里形成的混合物叫做乳浊液。
2、特征:不稳定,不均一。
3、能够促使两种互不相溶的液体形成稳定乳浊液的物质叫做乳化剂。乳化剂所起的作用称为乳化作用。
如:洗涤剂有乳化的作用,它能使植物油分散成无数细小的液滴,而不聚集成大的油珠。
二、浊液
1、分类
2、溶液和浊液的比较
溶液
悬浊液
乳浊液
分散在水里的物质
溶解性
溶
不溶
不溶
状态
固、液、气
固
液
分散在水里的粒子
分子或粒子
许多分子集合体
许多分子的集合体
特征
均一、稳定
不均一、不稳定
不均一、不稳定
静置后现象
静置后不分层、不沉淀
静置后会沉淀
静置后会分层
举例
食盐水、糖水、碘酒、CuSO4溶液
泥水、CO2通入石灰水后的浊液
油和水混合
相同点
都是混合物
例1、各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂不具有乳化功能的是( )
A.用汽油除去衣服上的油污
B.用洗洁精洗餐具上的油污
C.用肥皂液洗衣服
D.用沐浴露洗澡
答案:A
例2、完成下表并回答下列问题。
试管编号
加入液体
加入物质
实验现象
1
10mL水
一滴植物油
2
10mL汽油
一滴植物油
3
10mL水
几小粒碘
4
10mL酒精
几小粒碘
注:“实验现象”填“溶解”“不溶解”即可。
(1)上述实验说明同一种物质在__________的溶剂中溶解的能力__________;
(2)为什么汽油可用来清除衣服上的油渍?
(3)除去衣服上的油渍,用汽油和用洗涤剂洗,其原理是否相同?
答案:
试管编号
加入液体
加入物质
实验现象
1
10mL水
一滴植物油
不溶解
2
10mL汽油
一滴植物油
溶解
3
10mL水
几小粒碘
不溶解
4
10mL酒精
几小粒碘
溶解
(1)不同;不同
(2)因为植物油较易溶解在汽油中
(3)不同,前者是利用汽油能溶解油污,将其除去;后者是利用洗涤剂的乳化功能,将油污除去。
三、溶解时的吸热和放热现象
探究:NaCl、NaOH、NH4NO3溶于水是放热,还是吸热?
方案:先向三个小烧杯中分别倒入30mL左右的水,然后分别加入少量NaCl、NaOH、NH4NO3,搅拌使其溶解,再测量溶解后溶液的温度。
记录:
水中加入的溶质
NaCl
NH4NO3
NaOH
加入溶质前水的温度/℃
溶解现象
溶质溶解后溶液的温度/℃
结论
结论:
NaOH溶解时放热,使溶液温度升高;
NH4NO3溶解时吸热,使溶液温度降低;
NaCl溶解时没有明显热现象,溶液温度基本不变。
过渡:溶质溶解时为什么会有吸热放热现象呢?
1、溶解过程中的两种变化
(1)溶质的分子(或离子)向水中扩散,这一过程吸热;
(2)溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),这一过程放热。
2、溶解过程中温度的变化
(1)扩散吸热>水合放热,物质溶解时表现为吸热,溶液温度降低,如NH4NO3溶于水。
(2)扩散吸热<水合放热,物质溶解时表现为放热,溶液温度升高,如NaOH或浓H2SO4溶于水。
(3)扩散吸热=水合放热,物质溶解时热现象不明显,溶液温度基本不变,如NaCl溶于水。
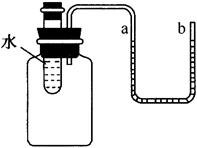
思考:除像上述探究中用温度计量溶液温度的变化,知道物质溶于水的热现象,还有什么方法证明NaOH溶于水放热或NH4NO3溶于水吸热?
(1)用手触摸溶解前后容器外壁;
(2)用如图所示装置进行实验,观察“U”型管中液面的变化。
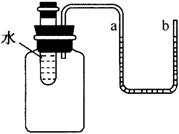
例3、如图所示,向小试管中分别加入一定量的下列物质,下侧U形管中液面发生明显变化,加入的物质不会是( )
A.硝酸铵固体 B.氢氧化钠固体
C.蔗糖固体 D.生石灰固体
解析:
溶解吸热:如NH4NO3溶解(扩散过程中吸收热量>水合过程中放出热量);溶解放热:如NaOH溶解、浓H2SO4(溶解扩散过程中吸收热量<水合过程中放出热量);溶解没有明显热现象:如NaCl(扩散过程中吸收热量≈水合过程中放出热量)。
答案:C
注意:溶解时热现象和化学反应热现象的区分。
溶解时主要发生的是物理变化,化学反应主要指的是化学变化。
四、影响溶解速率的因素
例4、小英在做饭时发现很多因素都能影响食盐在水中溶解的速度。
(1)从你能想到的可能影响食盐在水中溶解速率的因素中写出其中两项,并预测此因素对食盐溶解速率的影响。
因素①__________,你预测:__________。
因素②__________,你预测:__________。
(2)从你所列因素中选出一个,通过实验验证你的预测。你设计的实验是__________。
解析:
实验设计时要注意:①控制变量。该实验设计并要观察的变量(如搅拌)外其余变量(如水的体积,食盐的质量,颗粒的大小放入的时间、温度等)都应该始终保持相同。②测量变量,实验设计要说清楚变量如何测量(通过观察食盐溶解的全部时间,确定溶解快慢)。这里食盐用量要保证能最终完全溶解也是需要注意的要素。
答案:
(1)①温度;温度升高(温度降低)食盐溶解加快(减慢)
②晶体颗粒的大小;食盐颗粒越小溶解越快
③搅拌;搅拌能加快食盐的溶解
(2)搅拌影响:在两个烧杯中各放入50mL水,分别称取2g颗粒大小相同的食盐,同时放进烧杯中,在一个烧杯中搅拌,另一个烧杯不搅拌,观察并记录两个烧杯中的食盐完全溶解所需要的时间。
注意:影响溶解速率的因素和影响溶解性的因素的区别。
影响溶解速率的因素:①温度;②晶体颗粒的大小;③是否搅拌
影响溶解性的因素:①溶质的种类;②溶剂的种类;③温度
总结:
一、溶液、乳浊液、悬浊液的比较;乳化和溶解的比较
二、溶解时的放热和吸热现象
(1)扩散吸热>水合放热,物质溶解时表现为吸热,溶液温度降低,如NH4NO3溶于水。
(2)扩散吸热<水合放热,物质溶解时表现为放热,溶液温度升高,如NaOH或浓H2SO4溶于水。
(3)扩散吸热=水合放热,物质溶解时热现象不明显,溶液温度基本不变,如NaCl溶于水。
三、影响溶解速率的因素
影响溶解速率的因素:①温度;②晶体颗粒的大小;③是否搅拌。
- 返回 -