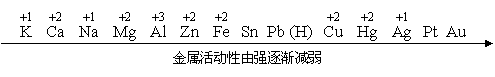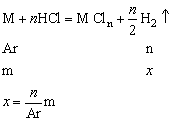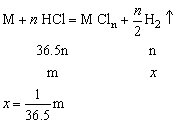| 金属的化学性质(2) |
主讲: 化学高级教师 舒宝生
复习:金属的活动性顺序
一、金属活动性顺序的应用
1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
注意:
(1)金属与浓硫酸、硝酸反应不生成氢气;
(2)金属越活泼,与酸反应生成氢气的速率越快。
举例:Mg+HCl;Mg+H2SO4
Al+HCl;Al+H2SO4
3、在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来。
注意:
(1)K、Ca、Na除外(因K、Ca、Na能与盐溶液中的水反应):
2K+2H2O=2KOH+H2↑
Ca+2H2O=Ca(OH)2+H2↑
2Na+2H2O=2NaOH+H2↑
(2)盐必须是可溶性盐
小结:金属活动性顺序的应用:
1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3、在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来。
二、金属和酸反应
1、金属和酸反应生成氢气的快慢:金属越活泼,与酸反应生成氢气的速率越快。
2、金属和酸反应生成氢气的多少
(1)酸足量时,金属反应完
当m相同时,产生氢气的多少与
成正比。
思考:相同质量的Mg、Al、Zn、Fe与足量的酸反应产生氢气的多少关系怎样?
(2)酸少量时,金属剩余
当m相同时,产生的氢气一样多。
思考:Mg、Al、Zn、Fe与相同质量少量的酸反应产生氢气的多少关系怎样?
总结:金属和酸反应生成氢气的多少。
(1)相同质量的金属与足量的酸反应,产生氢气的多少与
成正比。
(2)金属与相同质量少量的酸反应,产生氢气一样多。
讨论:mg的Zn和mg的Fe与相同质量ng HCl反应产生氢气多少的关系?
(1)酸足量,两种金属都反应完,Ar小的产出的氢气多。(
)
(2)酸少量,两种金属都剩余,产生的氢气一样多。
Zn + 2HCl=ZnCl2+H2↑ (
)
65 73
m x
Fe + 2HCl=FeCl2+H2↑
56 73
m y
注意:
时,铁剩余,锌恰好反应完,酸少量,产生氢气一样多。
(3)酸适量,一种金属反应完,一种金属剩余(Ar小的剩余),Ar小的产生氢气多。
总结:相同质量的+2价金属和酸反应产生氢气的多少
(1)酸足量,两种金属都反应完,Ar小的产生的氢气多;
(2)酸少量,Ar小的金属一定剩余,产生的氢气一样多;
(3)酸适量,Ar小的金属剩余,Ar大的金属反应完,Ar小的金属产生的氢气多。
三、金属和酸反应的应用
1、图象问题
(1)相同质量的Mg、Al、Zn、Fe和足量的HCl反应,画出产生H2的质量和时间的关系图。
(2)相同质量的Mg、Al、Zn、Fe和少量的相同质量的酸反应,画图产生H2的质量和时间的关系图。
注意问题,酸是否足量。
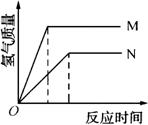
例1、等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如下图所示,下列叙述正确的是( )
A.M、N两种金属中较活泼的是N
B.生成H2的质量M<N
C.相对原子质量较大的是N
D.产生H2的速率N>M
答案:C
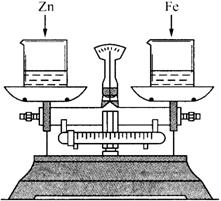
2、天平问题
例2、如下图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左
答案:D
解析:
锌与盐酸反应比铁与盐酸反应快,开始天平向右偏,最终铁与盐酸反应比锌与盐酸反应生成氢气多,天平向左偏。
3、含杂质的金属和酸反应的问题
例3、将26g某金属混合物投入到足量的稀硫酸中,共收集到2g氢气,该金属混合物的组成可能是( )
A.Mg和Zn B.Fe和Zn
C.Zn和Cu D.Cu和Fe
答案:A
总结:
一、金属活动性顺序的运用
1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3、在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来。
二、金属和酸反应
1、金属和酸反应生成氢气的快慢:金属越活泼,与酸反应生成氢气的速率越快。
2、金属和酸反应生成氢气的多少。
- 返回 -