| 原子的构成 |
主讲: 化学高级教师 舒宝生
复习:
1、什么是分子?
分子是保持物质化学性质的最小粒子。
2、什么是原子?
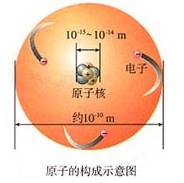
原子是化学变化中的最小粒子。原子在化学反应中不能再分。但原子不是不能再分,实际上原子是由原子核和核外电子构成的。
3、直接由原子构成的物质
金属单质、稀有气体单质、多数固态的非金属单质(如:碘不是)。
4、化学变化的实质
在化学变化中,分子分裂成原子,原子重新结合成新的分子。
引入:原子在化学反应中不能再分。但原子不是不能再分。
一、原子的构成

1、原子核所带的电量和核外电子的电量相等,但电性相反,因此整个原子不显电性,
核电荷数=质子数=核外电子数=原子序数
2、原子的质量主要集中在原子核上。
3、原子是“空心球体”,原子里有很大的空间,电子在其中做高速运动。
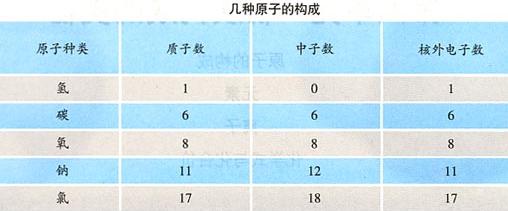
4、原子核内质子数不一定等于中子数,如普通氢原子核内无中子。
5、不同种类的原子,核内的质子数不同,核外电子数也不同。
6、自然界中存在核电荷数相同而中子数不同的原子,如碳-12、碳-13、碳-14。
过渡:原子的质量表示不方便
二、相对原子质量
定义:以一种碳原子(含有6个质子和6个中子的碳原子)质量的1/12作为标准,其他原子的质量跟它相比较所得的值,就是这种原子的相对原子质量。(符号为Ar)

1、质子和中子的相对质量均约为1。
2、近似相对原子质量=质子数+中子数
3、A、B两原子的相对原了质量之比等于A、B两原子的质量之比。
4、原子的质量与相对原子质量的区别与联系
|
原子的质量 |
相对原了质量 |
来源与性质 |
测定出来、绝对的 |
比较得出、相对的 |
数值与单位 |
非常小,有单位、为“kg” |
大于或等于1,有单位、为1 |
联系 |
|
|
总结:
一、原子的构成

核电荷数=质子数=核外电子数=原子序数
二、相对原子质量

近似相对原子质量=质子数+中子数
- 返回 -